Carenza marziale ed attività sportiva
Ultima modifica: 30 Novembre 2024

Prof. Roberto Miniero
L’Epidemiologia della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE
L’attività sportiva sia a livello agonistico sia a scopo ricreativo interessa milioni di ragazzi e ragazze in tutto il mondo. Secondo gli ultimi dati ISTAT in Italia sono circa 5 milioni i ragazzi/e di 3-17 anni che praticano nel tempo libero uno o più sport, rappresentando il 59,4% della popolazione di riferimento. Il 52,5% lo fa con continuità e il 6,9% saltuariamente. La pratica dello sport raggiunge il picco massimo tra i ragazzi di 11-14 anni (70,3% del totale, di cui 61% in modo continuo e 9,3% in modo saltuario) riducendosi al 52,1% tra i 15-17enni; al contrario l’attività sportiva saltuaria è caratteristica delle classi di età successive: svolgono saltuariamente uno sport il 13,6% dei 18-19enni e l’11,4% dei 20-24enni. Tra i giovani di 6-17 anni il 21% non pratica attività motoria (1). Le recenti analisi elaborate dal CONI, su dati ISTAT, evidenziano come attualmente siano poco più di 11 milioni le persone che praticano sport all’interno di società sportive del sistema CONI, attraverso le affiliazioni alle Federazioni Sportive Nazionali (FSN), Discipline Sportive Associate (DSA) ed Enti di Promozione Sportiva (EPS). Nel 2015 si contavano 4.535.322 atleti tesserati dalle FSN e dalle DSA e 6.663.165 tesserati agli EPS. Tra gli atleti tesserati delle FSN-DSA circa il 55% ha meno di 18 anni; la proporzione tra atlete e atleti è sbilanciata verso il genere maschile (73,1% vs 26,9%). La pratica sportiva inizia spesso in età giovanile (3-5 anni); tra gli 11-14 anni si ritrova la maggiore percentuale di praticanti sport in modo continuativo (58%), ed anche in questa fascia si evidenzia una maggior presenza di maschi (66%) (2).
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Area di Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
Fisiopatologia del metabolismo del Ferro
Nel soggetto adulto la quantità di ferro contenuto nell’organismo ammonta a circa 4 gr nel maschio e 2,5 gr nella femmina, mentre in età pediatrica è in relazione al peso corporeo. L’80% del ferro è presente in siti <<attivi>> quali emoglobina, mioglobina ed enzimi, il restante in siti <<inattivi >> o di deposito sotto forma di ferritina ed emosiderina. Circa lo 0,2% è trasportato nel sangue legato alla transferrina. Assorbimento e perdite mantengono un costante equilibrio e interessano solo l’1% dell’intero pool marziale dell’organismo. Il metabolismo del ferro è quindi sostanzialmente un sistema chiuso <<circolare>>, dove la quasi totalità del metallo dell’organismo è continuamente riciclata per soddisfare le richieste dei vari compartimenti. (Fig.1)
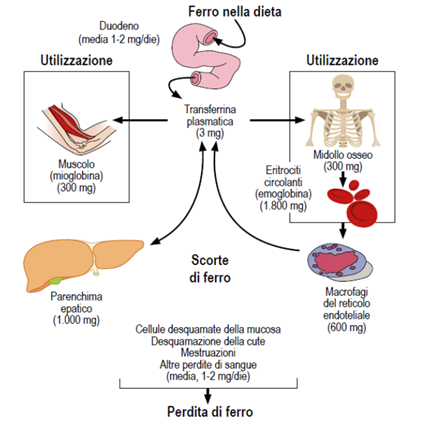
Fig. 1 Metabolismo del Ferro
La dieta occidentale contiene circa 6-7 g di ferro ogni 1000 Kcal, 80-90% in forma non-emica e il restante in forma emica (3,4). Secondo gli ultimi LARN (2014) le dosi giornaliere consigliate di ferro nel maschio e nella femmina sono rispettivamente 10 mg e 18 mg; per quanto riguarda l’età adolescenziale il fabbisogno è di circa 10-13 mg/die per i maschi e 18 mg per le femmine. L’assorbimento del ferro alimentare non-emico varia dal 2 al 15%, mentre il ferro emico, che rappresenta il 10% della dieta, è assorbito tra il 20 ed il 35% e rappresenta circa il 30% del totale del ferro assorbito. Nei soggetti vegetariani il fabbisogno alimentare sale a 18 gr per i maschi e 32 gr per le femmine, considerata la mancanza di ferro emico, meglio assorbito, nella loro dieta (5). In caso di perdite ematiche croniche, oppure periodi di aumentata richiesta, quali il rapido accrescimento, la gravidanza o l’attività sportiva agonistica, l’assorbimento intestinale può aumentare fino a quattro volte. Le perdite fisiologiche, se si escludono quelle mestruali, sono minime (circa 0,5-2 mg/die) e sono per lo più dovute a esfoliazione delle mucose (intestino, reni e polmoni) e della cute, e al sudore (3,4).
Prevalenza della carenza marziale negli atleti
Nei paesi a tenore di vita occidentale, la carenza marziale pre-anemica (CM) o un’anemia ferro-carenziale (AFC) interessa il 7-18 % dei bambini, il 24-36% degli adolescenti (3,5–13% dei maschi, 11-33% delle femmine), il 9-20% delle teenagers e delle giovani donne, meno dell’1% dei giovani adulti maschi. Nei soggetti che praticano sport agonistico la prevalenza della CM/AFC è maggiore rispetto ai soggetti che non lo praticano, i cosiddetti non attivi o <<sedentari>>, anche se non mancano rare segnalazioni di segno opposto (6-22).
Negli atleti una CM/AFC è da ascrivere in primo luogo all’adattamento del sistema eritropoietico all’esercizio fisico prolungato nel tempo che contempla una maggior richiesta di trasporto dell’ossigeno. Tuttavia il quadro fisiopatologico può essere complicato da un inadeguato apporto di ferro con la dieta, da un ridotto assorbimento intestinale, da perdite di sangue (flussi mestruali, perdite gastro-enteriche conseguenti agli <<scuotimenti dell’intestino>> dovuti all’esercizio o all’uso di farmaci quali i FANS) ed infine da aumentate perdite con il sudore (6-22).
Rapporto dieta/Ferro
La prima segnalazione del rapporto tra dieta (ferro) e performance sportiva, pubblicata su una prestigiosa rivista, risale al 1925 (23), ma solo dagli anni ’70 la letteratura scientifica si è arricchita di contributi che hanno studiato la presenza di CM/AFC negli atleti. Nel 1970 Yoshimura fu il primo autore a coniare il termine di <<anemia da sport>> per una particolare condizione che si osserva soprattutto negli atleti che praticano attività aerobica di endurance, già dopo alcuni giorni di allenamento intenso (24). Si tratta, in realtà, di una <<pseudo-anemia da emodiluizione>>, e non di una vera anemia, dovuta a un’espansione del volume plasmatico con riduzione percentuale della concentrazione dell’emoglobina (e dell’ematocrito) ma non della massa eritrocitaria in termini assoluti che, anzi, può aumentare per lo stimolo che l’esercizio fisico esercita sull’eritropoiesi (22,24).
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Area di Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
La Clinica
Soggetti adulti. Le casistiche evidenziano, pur con ampie variazioni nelle differenti discipline, come il 15-50% delle atlete ed il 2 e l’11% degli atleti presenta una CM/AFC (6-22). Studi su piccole coorti riportano percentuali più elevate, fino all’82% per le femmine, e al 30% per i maschi (6-22). L’esaustiva revisione di Dewoolkar et al., considerando 21 articoli per un totale di oltre 2000 atleti arruolati, ha riscontrato, pur con ampie variazioni tra gli studi, le differenti discipline sportive ed i differenti parametri ematologici valutati, una CM/AFC nel 1-50% degli atleti, con maggior incidenza nelle femmine (25). Uno studio di Wishnitner et al., eseguito su corridori di lunghe distanze, ha confermato, con l’aspirato del midollo osseo, la presenza di deplezione del ferro midollare negli atleti (26). |
Adolescenti e teenagers
Adolescenti e teenager. Gli adolescenti e i teenager sono maggiormente predisposti a sviluppare una CM/AFC per ragioni sostanzialmente riconducibili alle aumentate richieste legate allo sviluppo corporeo (soprattutto aumento della massa muscolare), alla comparsa delle mestruazioni, a diete incongrue (ipocaloriche o vegetariane-vegane) e a malassorbimento (celiachia in primis) (3,4). I dati della letteratura evidenziano come gli adolescenti ed i teenager che praticano attività sportiva abbiano maggior rischio di sviluppare una CM/AFC rispetto ai coetanei che non praticano attività sportiva (6-22). Sono state osservate anche variazioni legate ai mesi di regolare attività agonistica rispetto ai mesi di riposo. Così al termine del periodo di gare i valori di ferritina sono generalmente inferiori rispetto a quelli osservati all’inizio della stagione agonistica. Rowland et al. hanno riscontrato una prevalenza di CM/AFC nel 40% e nel 3% rispettivamente in un gruppo di atlete ed atleti adolescenti all’inizio della stagione agonistica (disciplina corsa). Al termine della stagione i valori aumentavano rispettivamente al 45% e al 17% (27). Gli stessi ricercatori, in un altro studio condotto su atlete (disciplina corsa), ha evidenziato come la ferritinemia media scendesse alla fine della stagione a 9±2 ng/mL rispetto ai valori medi di 14± 4 ng/mL di inizio stagione (28).
Uno studio svedese di Sandström et al., eseguito su 149 ragazze di età compresa tra 15 e 19 anni, di cui 57 atlete e 92 controlli (dati antropometrici, età del menarca, entità del flusso mestruale e dieta sovrapponibili nei due gruppi) ha evidenziato come il 52% delle atlete presentava una CM, contro il 48% dei controlli, con livelli di ferritina sierica più bassi nelle atlete con CM (14 ± 6 µg/L vs 17 ± 7 µg/L gruppo controllo). Una AFC era presente in 5 delle 57 atlete (8,6%) ed in 3 dei 92 controlli (3,3%) (29).
Uno studio polacco di Malczewska-Lenczowska ha valutato prospetticamente per 8 mesi 44 bambini, età media di 11 anni, 22 dei quali praticavano il nuoto come attività sportiva. I due gruppi non differivano per le caratteristiche antropometriche, sviluppo puberale G1/G2, e per assunzione quotidiana di ferro, che si attestava intorno ai 12 gr al giorno. Nel gruppo che praticava sport la ferritinemia mostrava una graduale diminuzione durante i mesi di osservazione (da 38,8 ± 7,2 µg/L a 24,7 ± 5,1 µg/L), mentre nel gruppo di controllo non si verificava una riduzione significativa (da 37,2 ± 4,8 µg/L a 32,3 ± 3,0 µg/L). Nel primo gruppo si evidenziava inoltre un aumento del recettore solubile della transferrina (rSTF), non presente nel gruppo di controllo. Il dato, come vedremo in seguito, è indicativo della presenza di eritropoiesi ferro carente pre-anemica. I livelli di emoglobina, invece, non mostravano variazione alla fine del periodo di osservazione in entrambi i gruppi (30). Una ricerca condotta dal polacco Pal et al. su 219 atlete, età media 16,9 ± 1,8 anni (range 13,7-20 anni), praticanti diverse specialità agonistiche, evidenziava una CM nel 60% dei casi, ma nessun caso di AFC. Veniva comunque riportato un aumento delle cellule ipocromiche e dell’RDW, nonché una diminuzione dell’emoglobina reticolocitaria, marcatori precoci di un’anemia ipocromica latente (eritropoiesi ferro carente) (31). Un altro studio di Spodaryk, analizzando 931 atleti di età media di 18 ± 3,5 anni, riscontrava una CM in 212 casi ed una AFC in solo 3 casi (0,3%) (32). Una ricerca israeliana di Shoemaker et al., ha analizzato una casistica di 91 adolescenti (69 maschi e 22 femmine) di età media di 12,2±2 anni che praticavano attività sportiva regolarmente. Una CM era presente nel 65% dei maschi e nell’86% delle femmine mentre una AFC era presente nel 46% dei maschi e nel 53% delle femmine (33).
Di Silvestro et al., valutando 39 studentesse dell’università dell’Ohio che correvano abitualmente sulle 3 miglia per fitness, ha evidenziato una CM in 21 di esse; nessuna è risultata anemica (34). Di Santolo et al., su 70 giovani pallavoliste dilettanti (età media intorno a 24 anni) hanno riscontrato una CM e una AFC rispettivamente nel 27,1% e nell’8,6% dei casi (35). Nabeyama et al., in 59 studenti universitari (39 maschi e 17 femmine) di età compresa tra 18 and 23 anni praticanti il kendo, non hanno evidenziato casi di anemia; ma in 7 (41%) ragazze era presente una riduzione della ferritine mia <30 ng/ml (36). Uno studio eseguito in Kuwait di Saleh et al. ha evidenziato una CM nel 36,7% ed una AFC nel 14,7% di 150 atlete, età media di 18 anni (37). Aguilo et al. analizzando 24 ginnaste di età media 14.1±2.3 anni non ha evidenziato una CM (38). Un altro studio spagnolo di Valtuela et al., eseguito su 57 ragazzi tra i 17 ed i 21 anni (disciplina calcio e pallacanestro), ha evidenziato come i giocatori di pallacanestro avessero valori acquisibili dall’esame emocromocitometrico mediamente inferiori rispetti ai giocatori di calcio, ma solo il 3% aveva una CM (39). Il gruppo finlandese di Tolvo et al. ha valutato una coorte di 199 atleti e 203 atlete (sport invernali e non), e una coorte di 62 maschi e 114 femmina non-atlete, di età compresa tra 14 e17 anni. La percentuale di CM era sovrapponibile nelle femmine indipendentemente dal fatto che praticassero o meno attività sportiva (22,7%). Al contrario nei maschi gli atleti mostravano una CM nel 26,5% dei casi contro un 30,2% nei non atleti. Il 3,5% delle atlete e l’1,5% dei maschi dichiarava di assumere supplementazioni di ferro (40). Park et al. hanno studiato 1536 studentesse e 1213 studenti di 25 college americani praticanti varie discipline sportive in un periodo di 12 anni (2002-2014). Tra le atlete il 4,3% ed il 32,8% avevano rispettivamente una riduzione dell’emoglobina e della ferritinemia; di queste il 2,2% mostrava una AFC ed il 30,9% CM. Tra gli atleti la riduzione era rispettivamente 9,3% e 4,8%, di questi l’1,2% aveva una AFC ed il 2,9% una CM (41). Uno studio tedesco di Koehler et al. ha valutato 193 atleti di differenti discipline (93 maschi e 97 femmine) di età media 16 anni. Una CM era presente nel 59% delle femmine e nel 31% dei maschi. Una AFC era presente rispettivamente nel 6,2% e 7,3% dei casi (42).
La CM e la TRIAD
La CM si associa spesso al quadro clinico TRIAD (dieta a basso contenuto calorico, disfunzioni mestruali e ridotta mineralizzazione delle ossa) (43). Il gruppo americano di Skorseth ha studiato 38 ragazze che praticavano corsa agonistica di età compresa tra 13 e 18 anni (media di 16,9±1 anni) evidenziando disordini alimentari nel 76,3% dei casi, amenorrea o oligomenorrea nel 45,9% dei casi, e ridotti valori di densitometria ossea nel 42,1% dei casi. La ferritinemia risultava <35 ng/ml in 25 casi. Sedici ragazze ricorrevano a supplementazione con ferro orale come automedicazione (43). In ragione della somiglianza in termini di esercizio fisico di lunga durata, merita ricordare come analoghi risultati sono stati ottenuti al di fuori dell’ambito sportivo in militari sottoposti ad addestramento per unità speciali. Uno studio israeliano di Epstein et al. ha valutato 52 soldati di 18-20 anni sottoposti ad addestramento per 15 mesi. Al termine il 29% presentava una AFC ed il 65% una CM (44). Un altro studio israeliano di Merkel et al., considerando 296 diciottenni di un’unità di soldati volontari, ha dimostrato una prevalenza di AFC del 18,5% (45).
Eziopatogenesi della CM e dell’AFC
La CM e l’AFC hanno negli atleti sostanzialmente la stessa eziopatogenesi che si riscontra nei soggetti che non praticano attività sportiva, ma a differenza di questi ultimi spesso più fattori concorrono nello stesso soggetto.
Il maggior sviluppo del tessuto muscolare degli atleti di entrambi i sessi e di ogni disciplina, rispetto ai soggetti che non praticano attività sportiva, comporta un aumento della sintesi di mioglobina e quindi un aumento delle richieste di ferro (6-22).
La maggior incidenza di CM nelle atlete rispetto agli atleti trova solo parziale spiegazione nelle perdite del ferro mestruale. Infatti, non infrequentemente (dal 10 al 75% dei casi, a seconda del tipo di attività sportiva), le atlete possono accusare oligomenorrea o amenorrea. Una disfunzione mestruale è riportato nel 12% delle nuotatrici e cicliste, fino al 20% nelle donne che praticano sport intenso, nel 44% nelle ballerine, nel 50% delle atlete di triathlon e nel 51% delle maratonete. Quando l’atleta abbassa il livello di allenamento, la dismenorrea regredisce. Il menarca può avere un ritardo di cinque mesi per ogni anno di allenamento intenso prima dell’inizio della pubertà (46).
Secondo gli ultimi LARN (2014) gli atleti che svolgono regolarmente un’intensa attività fisica soprattutto se di sesso femminile, hanno un fabbisogno superiore del 30-70% (5). Un fattore che può contribuire alla carenza di ferro soprattutto nelle atlete, è rappresentato da una dieta incongrua a basso contenuto energetico e scarso contenuto di ferro, o diete vegetariane/vegane (47-49). Nickerson et al. hanno segnalato consumi medi giornalieri di ferro ridotti rispetto ai valori dei LARN: 8,5 mg e 12,9 mg nelle femmine e nei maschi rispettivamente (50). Risultati analoghi sono stati riportati da Rowland (27-28).
Numerose evidenze dimostrano come l’esercizio fisico provochi un’aumentata perdita di ferro attraverso il sudore (fino a 2,5 µg/L). La sudorazione eccessiva, soprattutto quando l’esercizio è praticato in condizioni caldo-umide, può provocare un’importante perdita di ferro che può arrivare a 0,8-2 mg di ferro in poche ore di gara o di allenamento (6-22).
L’attività sportiva intensa può provocare abnormi movimenti (squotimenti) dell’intestino con eventi micro-ischemici ed emorragici e perdita di ferro. Ad esempio, dopo una maratona, è frequente osservare negli atleti (fino ad oltre l’80% dei casi) del sangue occulto nelle feci. La perdita di sangue durante allenamenti intensi e prolungati può variale da 1.5 mL/d a 6.6 mL/d. Dopo sforzi protratti possono comparire anche micro-ematurie. Si tenga presente come l’uso non infrequente di FANS negli atleti possa essere motivo di lesioni micro-emorragiche delle mucose gastroenteriche (6-22). Gli eventi traumatici da scuotimento possono produrre anche edema della mucosa con riduzione dell’assorbimento del ferro, come ben dimostrato da Ehn et al. con ferro radio-marcato (51).
Azab et al. hanno dimostrato come l’Helicobacter Pylori (HP) up-regoli la sintesi di epcidina rendendo conto, almeno in parte, della scarsa risposta al trattamento con ferro dei pazienti con AFC affetti da infezione da HP (52). Uno studio cinese di Choe et al. ha valutato l’impatto dell’infezione da HP nello sviluppo dell’AFC in un gruppo di 220 adolescenti (148 ragazzi e 72 ragazze) che praticavano attività sportiva e 440 adolescenti (228 ragazzi e 212 ragazze) che non la praticavano, di età era compresa tra i 15 ed i 17 anni. L’AFC era presente in 18 soggetti (8,2%) nel gruppo che praticava attività sportiva ed in 24 (5,5%) nel gruppo di controllo. L’infezione interessava 95 (43,2%) e 100 (22,7%) soggetti rispettivamente del gruppo di studio e di controllo. Una AFC correlata all’infezione, era presente in 12 (5,5%) e 10 (2,3%) ragazze rispettivamente nei due gruppi. I soggetti positivi al HP venivano quindi trattati con terapia specifica. In 11 pazienti si otteneva l’eradicazione della malattia con aumento dei parametri ematologici e della ferritinemia. Gli autori sottolineavano l’importanza di considerare anche questa infezione nel work-up dei ragazzi che svolgono attività agonista e che presentano una AFC, ed aggiungiamo noi, una CM (53). Al contrario nessuna correlazione tra CM/AFC ed infezione da HP in atlete e non atlete è stata osservata dallo svedese Sandstrom (29).
Un ruolo rilevante per l’insorgenza di CM/AFC degli atleti è dato dall’incremento dell’epcidina legato allo sforzo fisico. Il ferro non-eme è assorbito nel duodeno attraverso la Divalent Metal Transporter1 (DMT1) posizionata sul versante intestinale dell’enterocita. Entrato nell’enterocita il ferro si lega alla ferritina presente nel citoplasma. Il ferro è quindi esportato nel plasma ad opera della ferroportina presente sulla superficie basolaterale degli enterociti. Nel plasma il ferro è legato alla transferrina e trasportato agli organi di deposito e nei macrofagi dove è immagazzinato sotto forma di ferritina, o trasferito ai tessuti che utilizzano specificatamente il ferro, come ad esempio il midollo osseo. L’epcidina è una proteina sintetizzata negli epatociti che regola l’efflusso del ferro dall’enterocita e la sua disponibilità per i vari tessuti, il midollo osseo in primis, modulando l’azione della ferroportina e della efestina (3,4). Un aumento dell’epcidina determina una riduzione dell’assorbimento del ferro dall’intestino ed un suo blocco a livello dei macrofagi e degli altri tessuti di deposito.
I processi infiammatori, attraverso le interleukine (soprattutto l’IL-6), aumentano la sintesi di epcidina, mediata dalla via di segnalazione nucleare JAK/STAT3 e quindi riducono l’assorbimento del ferro (3,4). La contrazione muscolare legata allo sforzo fisico provoca uno stato infiammatorio, quindi un incremento dei livelli di IL-6 che a sua volta regola la produzione di epcidina. Il grado dell’infiammazione dipende dall’intensità e dalla durata dell’esercizio. Una recente revisione di Larsuphrom et al., analizzando 21 studi condotti su giovani adulti, ha confermato il ruolo centrale dell’epcidina nel modificare l’assetto marziale negli atleti che praticano sport di resistenza (54).
Studi sperimentali hanno evidenziato come l’esercizio fisico intenso aumenti anche la produzione di emojuvelina attivando un’altra via di segnalazione intracellulare che induce un maggior sintesi di epcidina (55). Per contro l’ipossia tissutale, quale si osserva dopo un esercizio anaerobio riduce la sintesi di epdicina con conseguente miglioramento dell’assorbimento e rilascio del ferro. Il meccanismo sembra mediato dal hypoxia-inducible transcription factors (HIF-1) e (HIF-2) (22); mentre lo studio di Mastrogiannaki et al. limiterebbe questa azione al solo HIF-1 (55).
L’attività aerobica degli sport di endurance, con la mediazione dell’epcidina, riduce l’assorbimento del ferro e provoca una carenza funzionale di ferro, ovvero una situazione in cui il ferro seppur presente nelle varie sedi di stoccaggio, non può essere dismesso ed utilizzato. Nell’esercizio di moderata intensità si ha invece una riduzione della sintesi di epdicina con aumento l’assorbimento e il rilascio di ferro dai depositi. La prevalenza di una o l’altra condizione dipende dal metabolismo aerobico o anaerobico prevalente durante lo svolgimento dell’attività sportiva nonché dalla durata e frequenza degli esercizi (56-61).
La concentrazione di IL-6 ed epdicina aumenta di 2- volte nelle 3 ore dal termine dell’esercizio e tende a tornare gradualmente a valori normali nell’arco di 24/72 ore (56-61).
La sintesi dell’ epcidina è anche dipendente dalla attività eritropoietica del midollo. E’ ridotta per un aumento dell’attività eritropoietica secondaria ad allenamenti a bassa intensità; in questo caso si ha un aumento dell’assorbimento del ferro. Diversa la situazione per l’attività fisica intensa e prolungata. In questo caso si ha uno stimolo eritropoietico molto più intenso con conseguente maggior richiesta di ferro. Ma in questa situazione si ha anche un incremento dei processi infiammatori, con riduzione dell’assorbimento del ferro e della sua mobilizzazione dai depositi. Queste considerazioni confermano come gli allenamenti intensi e prolungati creino uno sbilanciamento tra richieste, assorbimento e disponibilità del ferro, portando, nel tempo, ad una condizione di CM e di AFC (3,4,22,54,56-61). E’ stato inoltre evidenziato anche un rapporto tra deficit energetico nutrizionale ed aumento dell’epcidina. Le diete incongrue a basso contenuto energetico, cui spesso si sottopongono soprattutto le atlete, possono interferire in questo complesso meccanismo che coinvolge l’epcidina (22,54,56-61).
Gli ormoni sessuali interferiscono sull’assorbimento del ferro agendo sull’asse epcidina-ferroportina. Il ruolo del testosterone sull’eritropoiesi è noto da tempo, essendo questo capace di down-regolare il livello di epcidina. Una riduzione del testosterone anche del 20-40%, può manifestarsi per un’alterazione dell’asse ipotalamo-ipofisi-gonadi negli atleti di endurance rispetto ai controlli, con conseguente aumento dei livelli di epcidina (62,63).
Nelle atlete è possibile che attività sportive intense alterino il profilo ormonale, sopprimendo la secrezione di gonadotropin-releasing hormone (GnRH), precursore degli ormoni sessuali. Questo può portare alla soppressione/riduzione della sintesi dell’ormone luteinizzante (LH), dell’ormone follicolo-stimolante (FSH) e di conseguenza degli estrogeni. Tali eventi probabilmente contribuiscono all’amenorrea secondaria frequentemente riscontrata. Pochi studi fino ad oggi hanno studiato gli effetti specifici degli ormoni sessuali femminili sull’epcidina. L’estradiolo ridurrebbe la produzione di epcidina, mentre il progesterone, attraverso l’IL-6, ne aumenterebbe i livelli. Infine anche nelle donne, seppur presente a bassi livelli, il ruolo del testosterone sul metabolismo del ferro non debba essere ignorato (62,63).
In conclusione l’eziologia della CM negli atleti ripercorre quella natura multifattoriale che è alla base della CM dei soggetti <<sedentari>>, ma l’aumento dell’epcidina secondaria ai processi infiammatori propri della attività fisica gioca un ruolo cruciale (22).
Gli atleti possono presentare un’anemia non correlata alla CM alla quale tuttavia può associarsi. Un evento emolitico non è infrequente. Nel 1881 Fleischer descrisse il primo caso di emolisi acuta con emoglobunuria indotta da un intenso sforzo fisico (64). Negli ultimi decenni è stato ampiamente dimostrato come gli eritrociti dei soggetti che praticano attività sportiva possano subire eventi emolitici post-traumatici. Una forte contrazione muscolare, come nel nuoto, nel ciclismo, nel canottaggio, ma anche per discipline di breve durata come il sollevamento pesi, o un trauma ripetuto, come nell’impatto del piede a terra quando si corre per molti chilometri (es. maratona), possono provocare emolisi per la compressione o il danno dei capillari. Questa emolisi post-traumatica può provocare una lieve anemia ma non una perdita di ferro in quanto, come in tutti i processi emolitici, il ferro liberato dai globuli rossi è riciclato nell’organismo. Tuttavia, per effetto dell’incremento dell’epcidina il ferro potrebbe non essere completamente disponibile, ma piuttosto <<intrappolato>> dal sistema macrofagico. Qualora l’emolisi sia tale da saturare la capacità del sangue di legare il ferro all’aptoglobina ed all’emopexina, compare emoglobinuria e conseguente perdita di ferro. Da ricordare, infine, come il 6-8% degli atleti afroamericani sia eterozigoti per l’HbS e come questa condizione possa provocare emolisi ed eventi trombotici in caso di grave disidratazione (6-22).
L’emolisi può anche essere secondaria ad altre cause. Gli eritrociti degli atleti vengono sottoposti ad una elevata attività metabolica con maggiore produzione di radicali liberi, strettamente legata alla maggiore attività del metabolismo aerobico soprattutto negli atleti praticanti attività sportive di lunga durata come il mezzofondo, la maratona, la marcia, il ciclismo ecc… Questo fenomeno diminuisce il potenziale enzimatico e l’emivita dell’eritrocita, essendo l’eritrocita sprovvisto di nucleo e quindi non in grado di rimpiazzare le perdite enzimatiche. La vita media dei globuli rossi dei maratoneti è di circa 40 giorni, inferiore rispetto a quella stimata in soggetti che non svolgono attività sportive di lunga durata. In un soggetto sedentario vengono distrutti circa 150 miliardi di globuli rossi/giorno, mentre nell’individuo allenato intensamente la quota media di eritrociti distrutti al giorno è di circa 250 miliardi (6-22).
Tra i diversi fattori che contribuiscono ad aumentare la fragilità ed accelerare l’invecchiamento dei globuli rossi negli atleti praticanti attività aerobiche vi sono, oltre la maggiore produzione di radicali liberi, l’incremento delle sollecitazioni a carico di tutto il sistema cardiovascolare, l’aumentata produzione di catecolamine e la variazione del volume dei globuli rossi. Gli eritrociti più vecchi, che hanno subito l’attacco dei radicali liberi, sono più soggetti alla rottura. Inoltre, tutti quei fattori che determinano delle significative variazioni nella composizione del tessuto sanguigno (es. sudorazione) possono determinare una variazione del volume degli eritrociti e una minore deformabilità di questi all’interno del vasi tali da renderli più fragili. Una conferma dell’emolisi durante una maratona è stata fornita dal riscontro di una diminuzione dell’aptogobina al termine della prestazione. In caso di emolisi perpetuata nei corridori su lunga distanza potrebbe manifestarsi la cosiddetta<<macrocitosi del corridore>> dovuta all’aumento di neociti secondario alla reticolocitosi reattiva all’emolisi (6-22).
Altre due forme di anemia sono caratteristiche dell’atleta. Una è l’anemia acuta da sport. Si tratta di un quadro che può insorgere frequentemente in soggetti non allenati che intraprendono un esercizio fisico intenso, ma anche in soggetti allenati impegnati in esercizi di lunga durata, oppure in prestazioni ripetute di elevata intensità. La patogenesi dell’anemia acuta è multifattoriale ed è legata a fattori meccanici (impatto dei vasi superficiali della pianta del piede) e fisico-chimici (alterazioni della resistenza osmotica degli eritrociti dovuti alla emoconcentrazione, all’aumento di radicali liberi e di acido lattico, all’aumento della temperatura corporea) (6-22).
Una caratteristica peculiare degli atleti, e in particolare dei praticanti attività di resistenza è la pseudo-anemia da emodiluizione di cui si è fatto cenno precedentemente. Si osserva in circa il 10-15% degli atleti soprattutto quando il tempo di allenamento supera le 10 ore settimanali e negli eventi sportivi che durano diversi giorni (ad es. corse a tappe in bicicletta su strada). L’iniziale emoconcentrazione, dovuta a sudorazione che determina il trasferimento di liquidi dal plasma ai tessuti, stimola il rilascio di renina, aldosterone e vasopressina con conseguente aumento della pressione osmotica del plasma. Pertanto, specialmente nelle prime settimane di allenamento, si determina un’emodiluizione (il volume del plasma può espandersi fino al 20% ovvero da 300 a 1000 ml), con conseguente riduzione della concentrazione dell’emoglobina e dell’ematocrito, ma non della massa eritrocitaria, che anzi, per effetto dell’incremento di eritropoietina, potrebbe aumentare del 10-18%. In questo caso le prestazioni atletiche non sono influenzate poiché non è ridotto l’apporto di ossigeno. L’entità dipende dall’intensità e dalla durata dello sforzo. Avere un alto volume di plasma accompagnato da un basso ematocrito non è uno svantaggio, anzi ha effetti benefici sulle prestazioni, in quanto migliora la termoregolazione, aumenta il pre-carico cardiaco e migliora la capacità di diluire i metaboliti. Gli spostamenti di volume del plasma indotti dall’esercizio sono di solito reversibili entro qualche giorno dalla cessazione dello sforzo. Diversi studi in letteratura riportano un decremento della capacità aerobica in risposta ad anemia da sport (6-22).
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Area di Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
La Clinica
Il ferro svolge un ruolo fondamentale in numerosi processi metabolici in differenti organi e tessuti, intervenendo in oltre 180 reazioni biochimiche, la principale delle quali è la
La presenza di una normale quantità di ferro nell’organismo è fondamentale per un buon stato di salute ed adeguate performance psicofisiche. Il ferro si trova, infatti, in numerosem biomolecole e gioca un ruolo in più di 180 reazioni biochimiche, compreso il trasporto di elettroni in reazioni redox (citocromi, proteine solforiche), funzioni catalitiche (citocromo P450, catalasi, perossidasi) e trasporto dell’ossigeno (emoglobina, mioglobina). Svolge anche un ruolo importante nella produzione di neurotrasmettitori ed è essenziale nella sinaptogenesi e nella mielinizzazione. Il ferro, attraverso vari enzimi e citocromi, interviene soprattutto nel metabolismo energetico aerobico. La fosforilazione ossidativa è la via biochimica in cui il ferro è più spesso coinvolto. Il ferro, come cofattore della catalasi, svolge un ruolo importante nella difesa antiossidante (3,4).La sua carenza non si riflette solo sull’eritropoiesi ma ha conseguenze anche a livello sistemico. L’anemia riduce il trasporto dell’ossigeno. La carenza di ferro pre-anemica riduce l’attività mitocondriale e di molti enzimi della catena respiratoria diminuendo la resistenza fisica (3,4). Così se nel soggetto<<sedentario>> la CM e la AFC moderata decorrono per lo più in maniera asintomatica o possono manifestarsi con astenia e/o scarsa tolleranza al normale esercizio fisico, la ridotta performance diventa invece evidente negli atleti già nella fase di carenza marziale pre-anemica. Per queste ragioni risulta evidente come nell’atleta la CM possa essere intercettata più precocemente rispetto ai soggetti <<sedentari>>. Sono anche noti i rapporti tra CM cronica e possibile compromissione del sistema nervoso centrale, con deficit cognitivi, dell’attenzione, della memoria, dell’apprendimento, della motricità fine e della fluidità verbale (3,4). Infine nell’atleta la CM può condurre a scarsa motivazione ed acuire l’eventuale astenia.
Diagnosi di laboratorio della CM e delle AFC
L’AFC è la tappa finale di un processo di progressivo depauperamento del ferro.. Nelle fasi iniziali di questo processo diminuisce solo la ferritina sierica. Successivamente inizia a ridursi la sideremia, ad aumentare la transferrina ed a ridursi l’Indice di Saturazione della transferrina; in questa fase intermedia si modifica anche il recettore solubile della transferrina (sTfR). Solo in una fase successiva, iniziano a modificarsi i parametri eritrocitari.
La diagnosi di CM pre-anemica si pone con la valutazione di parametri biochimici (3-8,64-68):
- Diminuzione della sideremia < 30mg/dl
- Aumento della transferrinemia totale (o espressa come TIBC) > 350 mg/dl
- Diminuzione dell’indice di saturazione della transferrina <16%-20%
- Aumento del recettore solubile della transferrina (sTfR): compare quando le riserve di ferro sono esaurite o in via d’esaurimento; risulta un indice sensibile e specifico di eritropoiesi ferro-carente (stadio III). Può fluttuare del 4-16% durante la giornata. Questo parametro non essendo influenzato dai processi infiammatori, dagli esercizi fisici e da brevi periodi di allenamento è stato proposto per la sua sensibilità e specificità per la valutazione del ferro negli atleti.
- Diminuzione della ferritinemia: valori inferiori a 12-15 ng/ml sono considerati quali indicatori di una CM con esaurimento delle scorte di ferro nel soggetto normale (dallo stadio I). Il parametro è tuttavia influenzato dai processi infiammatori (in effetti, si tratta di una proteina di fase acuta) che ne fanno aumentare i valori indipendentemente dalle scorte di ferro. Può fluttuare del 13-75% in valutazioni giornaliere sequenziali. Negli adulti con processi infiammatori cronici il cut-off è incrementato a 50-100 ng/ml. Negli atleti, in considerazione dei processi infiammatori cui vanno incontro, il cut-off rimane ancora in discussione. Nei lavori della letteratura che hanno valutato la prevalenza della CE/AFC sono stati usati valori variabili da 20 a 40 ng/ml. Al momento la maggioranza degli autori ritiene che nei ragazzi/e tra 6 e 12 anni e negli adolescenti che praticano attività sportiva il cut-off debba essere di 15 ng/ml e 20 ng/ml rispettivamente. Nei giovani adulti atleti il cut-off è spostato a 35-50 ng/ml. A seconda della durata e dell’intensità dell’attività, i valori di ferritina possono rimanere normali o mostrare un aumento anche fino al 27% con un ritorno alla linea di base entro un giorno; in caso sforzi intensi e prolungati, come nella maratona, i valori possono essere raddoppiati rispetto a quelli pre-gara e tornare alla normalità solo dopo sei giorni. Il sTfR e il rapporto sTfR/ ferritinemia è considerato un indice molto sensibile per diagnosticare una CM funzionale pre-anemica.
Per porre diagnosi di AFC occorre valutare anche l’esame emocromocitometrico che evidenzierà (3,4):
- Riduzione di oltre 2DS dell’Hb, dei GR e dell’Ht rispetto ai valori di riferimento per età e sesso. Per quanto riguarda gli adulti la WHO stabilisce come valore indicativo di anemia 13 gr/dl per gli uomini e 12 gr/dl per le donne. Per i ragazzi < 15 anni il cut-off per l’emoglobina è considerato 11,5 g/dL. Per gli adolescenti> 15 anni i valori sono sostanzialmente gli stessi degli adulti.
- Riduzione del MCV, del MCH e del MCHC rispetto ai valori di riferimento per età
- Aumento dell’ RDW > 15%
- Diminuzione del CHr <27,5 pg
- Striscio di sangue periferico: emazie ipocromiche con tendenza alla microcitosi
- Non infrequente la presenza di una trombocitosi < 1.000.000 mmc
- La percentuale di eritrociti ipocromici. E’ un parametro sensibile per la diagnosi precoce di carenza marziale pre-anemica con eritropoiesi ferrocarenziale.
Non sempre però, Hb e Ht sono sufficienti per diagnosticare una reale condizione di anemia. Molto spesso, infatti, gli atleti, soprattutto praticanti discipline sportive di fondo o allenamenti prolungati, manifestano fenomeni di pseudoanemie da emodiluizione che riducono i valori relativi riguardanti Hb, globuli rossi ed Ht, ma non alterano gli indici eritrocitari quali MCV, MCH ed MCHC (22).
Trattamento
In linea generale l’obiettivo del trattamento dell’AFC è quello di fornire un quantitativo di ferro adeguato per normalizzare i livelli di emoglobina e per ricostituire le scorte di ferro (ferro di deposito). Il trattamento si basa su tre cardini: 1) identificazione e rimozione delle cause della sideropenia; 2) somministrazione di preparati di ferro medicamentoso per via orale o per via endovenosa per normalizzare i livelli di emoglobina e gli altri parametri ematologici; 3) prolungare la terapia anche dopo la normalizzazione dell’emoglobina per ricostituire le scorte (in genere 3-6 mesi di trattamento). La terapia marziale va iniziata già nella fase pre-anemica (qualora intercettata) per contrastare gli effetti sistemici della carenza marziale e per evitare la progressione verso l’anemia. Analogamente a quanto avviene nella popolazione generale, anche per quanto riguarda gli atleti il trattamento della CM/AFC si basa in prima istanza sulla identificazione e rimozione, quando possibile, delle cause della sideropenia non correlate all‘attività sportiva (3-8,22,68-71).
La correzione di una dieta ipocalorica a scarso contenuto di ferro o di una dieta vegetariana squilibrata deve rappresentare il primo passo per correggere la CM negli atleti (3,4,47-50). La supplementazione di ferro medicamentoso è effettuata in prima istanza per via orale. Nel caso si debbano ristorare rapidamente le scorte di ferro si può ricorrere alla somministrazione del ferro per via venosa (3,4,68-71).Numerose preparazioni di ferro ferroso o ferrico sono oggi a disposizione degli atleti. Il ferro orale può essere somministrato sotto forma di sale ferroso (Fe++) o ferrico (Fe+++). Analogamente al ferro non-emico della dieta, quello medicamentoso è assorbito in forma bivalente a livello di duodeno e primo tratto del digiuno ad opera della DMT-1 e regolato dall’epcidina, I preparati trivalenti devono essere ridotti a bivalenti ad opera della ferroriduttasi presente sulla superficie delle cellule intestinali. L’assorbimento del ferro medicamentoso non supera il 10-35% della dose somministrata e varia in base al tipo di sale (quelli ferrosi assorbiti 3 vote più di quelli ferrici), alla presenza di cibo nello stomaco (a digiuno il ferro è assorbito il 20-50% in più ma è meno tollerato) ed al grado di anemia (più è marcata maggiore è l’assorbimento). (Fig. 2)
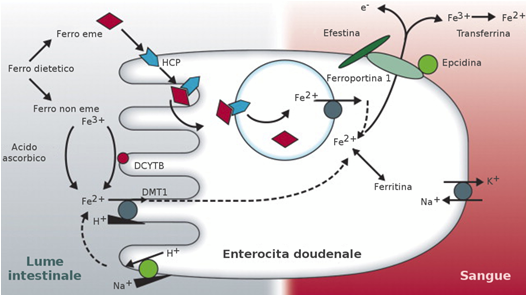
La Fig. 2 racconta il complesso meccanismo dell’assorbimento del ferro.
Il solfato ferroso a distanza di quasi due secoli dalle osservazioni di Pierre Blaud che trattò le sue pazienti affette da clorosi, per la prima volta e con buon risultati, con questo composto (pillole di Blaud), rimane il trattamento di riferimento. In un testo di inizio ‘900 il medico berlinese Grawiz confermava come la <<cura ferruginosa>> fosse essenziale nel trattamento della clorosi. Lo stesso autore confermava l’efficacia delle pillole di Blaud, sottolineando tuttavia come già al tempo fosse straordinariamente ricco l’assortimento di preparati di ferro organico (solfato, carbonato, cloruro, sesquicloruro), o combinato in forma albuminato ( anche in versione liquorosa ), o in formulazioni contenenti emoglobina oltre che in << acque ferruginose>>..
Questo sale, nel 10-73% dei pazienti, dimostra scarsa tollerabilità gastroenterica (epigastralgia, nausea, vomito, flatulenza, dolori addominali, stipsi o diarrea) che può rendere difficile l’aderenza alla prescrizione. Per limitare gli effetti indesiderati sono state, negli anni, commercializzate altre formulazioni di Fe++quali il fumarato, il gluconato, il pidolato, la ferroglicina, il bisglicinato chelato (FBC), e più recentemente il FBC alginato (Feralgina®, non prescrivibile al momento al di sotto dei 14 anni), o di Fe+++ quali il ferrosaccarato, il ferromaltoso, il ferrosodico EDTA ed il ferro sucrosomiale o liposomiale. La quantità di ferro elementare è variabile (dal 10% ad oltre il 30%) da un preparato all’altro e rappresenta il parametro a cui riferirsi per la prescrizione.
. E’ stato dimostrato come una singola dose di ferro aumenti la sintesi di epcidina, con riduzione dell’assorbimento del ferro per almeno 24/48h, e saturi per lo stesso periodo la capacità funzionale della DMT-1 presente sulla superficie delle cellule duodenali. Conseguentemente l’assorbimento subisce un importante decremento durante questo lasso di tempo. Studi clinici su soggetti adulti hanno evidenziato come durante un ciclo terapeutico con somministrazione a giorni alterni, l’assorbimento della quantità totale di ferro risulti sovrapponibile a quella ottenuta con la somministrazione giornaliera, ma con minori effetti indesiderati e minori costi. Mancano al momento studi su bambini/adolescenti, ma le basi teoriche suffragano la possibilità di adottare questo regime anche in età pediatrica. Anche per gli atleti è raccomandabile la somministrazione a giorni alterni che garantirebbe lo stesso risultato terapeutico con minori effetti collaterali. La Feralgina®, comportando una più lenta e costante dissoluzione del ferro nello stomaco sia rispetto ai comuni sali ferrosi quanto verso il FBC, aumenta l’assorbimento del ferro grazie all’assenza di saturazione dei recettori DMT-1, consentendo l’utilizzo di una somministrazione quotidiana a dosaggio ridotto rispetto ad altri composti. (3,4,72).
Considerando il rapporto tra esercizio fisico e sintesi di epcidina potrebbe essere interessante stabilire la somministrazione in relazione ai livelli di epcidina, ma è difficile stabilire delle regole precise, considerando i diversi fattori che possono influenzare il complesso fenomeno dell’assorbimento del ferro. In linea di massima sembrerebbe sconsigliabile l’assunzione del ferro nelle tre ore successive l’esercizio fisico; tuttavia i dati non sono univoci. Un recente studio di McCormick et al. ha evidenziato come la somministrazione del ferro di mattina, entro 30 minuti dal termine di un allenamento di 90 minuti, è maggiore di quello che si osserva nel pomeriggio nelle stesse condizioni. Questa differenza sarebbe da attribuire al ritmo circadiano della sintesi dell’epcidina (ridotta al mattino). Infatti, al mattino nonostante l’esercizio la sintesi di epcidina rimane inferiore a quello che si osserva nel pomeriggio dopo lo stesso esercizio fisico; questo fattore permette un migliore assorbimento del ferro (73).
Nella maggior parte degli studi condotti sugli atleti il ferro glucosato, il ferro fumarato ma soprattutto il ferro solfato sono state le formulazioni di ferro bivalente più utilizzate, in armonia con quanto indicato dalle linee guida per il trattamento della CM/AFC nella popolazione generale. Il dosaggio raccomandato varia da 60 a 200 mg/die di ferro elementare. La comparsa di effetti indesiderati secondari alla assunzione del ferro assume particolare rilevanza per un atleta che necessita di uno stato di salute ottimale per allenamenti e gare, e può essere causa di interruzione volontaria del trattamento. Come per i soggetti che non praticano attività agonistica in caso di effetti collaterali il solfato ferroso va sostituito con composti più tollerati. Mancano tuttavia studi che abbiano approfondito questo aspetto, al di là di generiche raccomandazioni. Numerosi studi hanno dimostrato come il ferro bisglicinato chelato sia un ottimo sostituto del solfato ferroso essendo meglio assorbito (4-5 volte di più) e con rari eventi secondari (74). Butt et al. ne ha dimostrata l’efficacia in un studio controllato effettuato su 20 atleti (75). Nel 2016 una nota dell’Association of Accredited Naturopathic Medical Colleges lo raccomandava per gli atleti in virtù del buon assorbimento e pressoché assenza di effetti collaterali (76). Una recente revisione di McCormick et al. lo candida come valida alternativa al solfato ferroso e ad altri composti ferrosi. (77). E’ verosimile che un preparato come il ferro bisglicinato chelato coniugato con alginato (FeralginaTM), che rappresenta un miglioramento del ferro bisglicinato chelato anche per la maggior protezione gastrica dovuta all’alginato, possa essere un prodotto particolarmente indicato per gli atleti che spesso utilizzano antiinfiammatori, farmaci contraddistinti per la loro azione lesiva sulla mucosa gastrica (78).E’ ben documentato come l’AFC, oltre che sullo stato di salute, influisca sulle performance psico-fisiche dei soggetti non attivi della popolazione generale ed a maggior ragione degli atleti. Il suo trattamento è quindi d’obbligo in ogni caso (22,68-71). E’ invece aperto il dibattito se e come trattare la CM nella popolazione generale, anche se la maggior parte degli autori ritiene comunque utile un intervento sia in età pediatrica che negli adulti (3,4,8,79). Per quanto riguarda la CM negli atleti i dati che riguardano la sua influenza sulla performance non sono del tutto univoci, anche se nella maggioranza dei casi ne supportano la correlazione e ne suggeriscono il trattamento. Una revisione di Rowland et al. ha riportato 4 studi in cui la supplementazione di ferro non modificava le prestazioni, ed altrettanti che invece ne evidenziavano un miglioramento. Lo stesso autore tuttavia ha segnalato la difficoltà interpretativa dei dati per le differenti condizioni degli atleti ed i criteri di valutazione della performance tra i vari studi (27,28). Una recente revisione di Robeor et al. ha esaminato 12 lavori della letteratura, per un totale di 283 soggetti di 13-41 anni, di cui 257 femmine e 26 maschi. Secondo gli Autori la somministrazione di solfato ferroso (100-150 mg di ferro elementare al giorno per 6-8 settimane) migliorava le performance dei soggetti con ferritinemia inferiore a 20 ng/L ma non di quelli con valori superiori. La ferritinemia aumentava del 30-50% dopo il trattamento (79). Clenin et al. suggeriscono la somministrazione di 28-50 mg di ferro elementare 2-3 volte alla settimana fino a normalizzazione dei parametri ematochimici (80). Della Valle et al. hanno analizzato 11 studi che valutavano l’impatto della supplementazione con ferro in atlete con CM confermandone gli effetti positivi. Gli stessi autori suggeriscono dosaggi più contenuti (20 mg/d di ferro elementare come solfato ferroso) rispetto ad altri autori (81). Burden et al. hanno evidenziato in una metanalisi come la supplementazione con ferro migliori i parametri biochimici e la performance aerobica in atleti di endurance con CM (82).Un recente lavoro di MaCormick et al.ha proposto l’algoritmo qui sotto riportato per la diagnosi ed il trattamento della CM/AFC negli atleti applicabile anche nel soggetto adolescente (83).
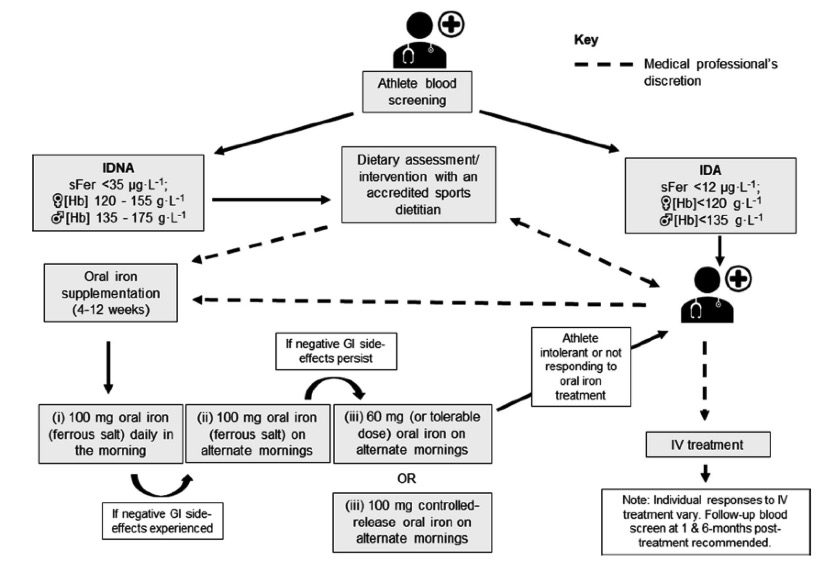
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Area di Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
Un lavoro del gruppo svedese di Axling ha studiato 42 atlete con CM (ferritina < 30 ng/L) dimostrando come l’aggiunta del Lactobacillus plantarum 299v a 20 mg di ferro bivalente per 12 settimane migliorasse i valori di ferritinemia (+70%) rispetto al gruppo trattato solo con ferro (+42%). I dati suggerivano anche un più rapido aumento della ferritinemia, visibile già dopo 4 settimane di trattamento con il probiotico. Nessun miglioramento invece della performance valutata strumentalmente. Tuttavia gli autori hanno evidenziato anche una migliore percezione della proprio <<vigor>> nelle atlete del gruppo di studio. L’effetto migliorativo del Lactobacillus plantarum 299v è verosimilmente da attribuire alla capacità di ridurre lo stato infiammatorio e quindi mitigare gli effetti dell’epcidina (84). Uno studio di Sandroni et al. in 32 atlete ha confermato come l’associazione di prebiotici e probiotici al solfato ferroso migliori il quadro marziale (85).Il ferro non può essere considerato un prodotto ergogenico in assenza di una CM. Normalizzati i parametri, il trattamento va interrotto poiché l’eccesso di ferro risulta dannoso e non aumenta la performance sportiva. Vanno disincentivate le somministrazioni di ferro medicamentoso autogestite dagli atleti senza la valutazione ematochimica. Petroczi et al. hanno effettuato uno studio per valutare quanti atleti (inglesi) assumessero ferro indipendentemente dagli esami ematochimici: il 29,8% degli intervistati dichiarava di assumere abitualmente supplementazioni di ferro non necessariamente sotto controllo medico (86). Uno studio di Zotter et al. del 2004 su ciclisti professionisti ha evidenziato come il 45% avesse una ferritine mia > 350 ng/ml e circa il 25% l’avesse > 500 ng/ml (86). Dati che inequivocabilmente dimostravano un uso continuo di supplementazioni di ferro senza controllo biomedico tra gli atleti. Il rischio di un sovraccarico di ferro legato alla presenza di un genotipo per l’emocromatosi, come sottolineato da Zotter, non va sottovalutata (87).
Prevenzione e Screening
Una dieta adeguata per contenuto di ferro è il primo passo per prevenire la comparsa di CM negli atleti. Il secondo è intercettare precocemente la CM. Le società scientifiche di Medicina dello Sport hanno programmi di monitoraggio dell’assetto marziale negli atleti, modulati in ragione dell’età, del sesso, della disciplina, dell’attività amatoriale o professionale. Perciò è possibile intercettare precocemente condizioni di CM o finanche di AFC in modo da attivare virtuosi percorsi diagnostico-terapeutici (88,89). Nello stesso tempo con questa attività di screening si possono individuare eventuali abusi nella somministrazione di ferro da parte degli atleti o casi di vero e proprio doping (uso di eritropoietina, testosterone trasfusioni di sangue ecc).
Conclusioni
Il solfato ferroso, a distanza di quasi due secoli dalle osservazioni di Pierre Blaud (1832) che trattò le sue pazienti affette da clorosi, per la prima volta e con buoni risultati, con questo composto (pillole di Blaud), rimane il composto di riferimento. In un testo di inizio ‘
CM/AFC possono ritenersi un vero e proprio quadro fisiopatologico dell’atleta, soprattutto se praticante discipline sportive di lunga durata. La CM/AFC sono, infatti, più frequenti negli adulti e negli adolescenti/teenager che praticano attività sportiva in modo continuativo, anche se amatoriale, rispetto ai coetanei non attivi. Ne sono più interessate le atlete. La frequenza varia anche in ragione della disciplina; quelle di endurance sono più a rischio. L’eziopatogenesi è multifattoriale, ma l’aumento dell’epcidina secondaria allo stato infiammatorio proprio degli atleti gioca un ruolo importante.
Posta la diagnosi di AFC deve essere iniziato un trattamento per os con un preparato che sia ben assorbito e ben tollerato. Per quanto riguarda la CM il problema è più complesso. L’identificazione della CM negli atleti e la successiva supplementazione farmacologica presenta ancora aspetti problematici per i differenti protocolli diagnostico-terapeutici, il tipo di prestazione misurata e i differenti cut-off della ferritina sierica considerati nei vari studi. Tuttavia un’integrazione farmacologica rientra tra le raccomandazioni della maggior parte degli autori. La comparsa di effetti collaterali legati alla somministrazione di ferro, minando lo stato di benessere indispensabile all’atleta, è spesso causa di interruzione del trattamento. Occorre quindi che venga individuata la miglior terapia per ciascun atleta ricercando il composto più efficace e meglio tollerato. Sono da sconsigliare somministrazioni autogestite di ferro per i possibili danni da sovradosaggio. Screening periodici dello stato marziale sono raccomandabili per gli atleti sia per individuare stati carenziali pre-anemici quanto per intercettare possibili sovradosaggi da automedicazione o casi di doping.
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Area di Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
La diagnostica si basa sulla valutazione di parametri ematologici e biochimici ed é, in genere, relativamente facile. Nel bambino il trattamento è importante per garantire un normale accrescimento staturo-ponderale e per evitare i danni cognitivo-comportamentali; nell’adulto per migliorare la performance psico-fisica e per migliorare la qualità di vita. La terapia, tuttavia, può presentare delle criticità. I possibili effetti indesiderati e la durata possono, infatti, porre problematiche di aderenza alla prescrizione. Al medico compete, oltre ad una ricerca esaustiva delle cause e del miglior trattamento per il singolo paziente, anche l’impegno in una efficace comunicazione per ottenere una adeguata compliance ed evitare terapie inefficaci; al paziente compete di seguire con scrupolosità le prescrizioni farmacologiche e dietetiche del curante.
Roberto Miniero1
Maria Concetta Galati2
Giuseppe Raiola1
Paola Saracco3
Giuseppe Antonio Mazza4
Valentina Talarico1
1 Dipartimento Materno Infantile, Azienda Ospedaliera “Pugliese-Ciaccio” di Catanzaro
2 S. O. C di Oncoematologia Pediatrica, Azienda Ospedaliera “Pugliese-Ciaccio” di Catanzaro
3 S. O. C. di Ematologia Pediatrica, Città della Salute e della Scienza. Torino.
4 S. O. C. di Cardiologia Pediatrica, Città della Salute e della Scienza. Torino.
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Area di Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
Bibliografia
Categorie
- Allergie e intolleranze
- Apparato Urogenitale
- Autismo e Disturbi dello Spettro Autistico
- Benessere Psichico e Salute mentale
- Caduta dei Capelli
- Coronavirus
- Disfunzioni della Tiroide
- Disturbi Alimentari
- Disturbi del Sonno
- Disturbi Gastrointestinali
- Epidemie e pandemie
- Farmaci - Terapie - effetti collaterali
- Malattie Autoimmuni
- Malattie infettive
- Malattie Infiammatorie
- malattie renali
- Malattie Respiratorie
- Malattie Reumatiche
- News
- Patologie Cardiovascolari
- Patologie del Piede
- Patologie del Sangue e della Coagulazione
- Patologie del Sistema Nervoso
- Patologie della Pelle
- Patologie Oculari
- Prevenzione e salute
- Problemi Muscoloscheletrici
- Salute dei Bambini
- Salute dell'Anziano
- Salute della Donna
- Telemedicina
- Terapie e Rimedi Naturali
- Terapie Oncologiche
- Viaggi e Salute
- Video
- Vivere con il Diabete